Amgen Worldwide
A biotechnology pioneer since 1980, Amgen has reached millions of patients around the world.
オンラインリソース
アムジェンは、患者さんが関心のある分野について学べるよう、多数のリソースを用意しております。
A biotechnology pioneer since 1980, Amgen has reached millions of patients around the world.
アムジェンは、患者さんが関心のある分野について学べるよう、多数のリソースを用意しております。
医薬品開発には時間がかかる、という性質は避けられないものではありません。アムジェンは、イノベーションによって解決できる問題と考えています。私たちがこの課題にどう対応しているのか、ご紹介します。
新薬を患者さんに届けるまでのレース
数百万人もの患者さんが、より豊かな生活を送るための新薬を待っています。アムジェンでは、その待ち時間をできるだけ短くするためにベストを尽くしています。
しかし、研究室から患者さんにまで届く試験薬はごくわずかです。10年以上という長い旅を経て完成することもしばしばあります。
そこで私たちは、医薬品開発を再設計して、高品質な治療薬がより早くゴールラインを超えることを目指しています。
こうした戦略は、通常の研究開発プロセスよりも多くのリソースを必要とするかもしれません。一般的に、新たな承認薬を患者さんにお届けできるようになるまでに平均26億ドルかかっています。しかし、新たな治療法が大きな変化をもたらす可能性があるのなら、この追加の投資には価値があります。
選択肢がほとんどない疾患の治療を前進させるチャンスがあるとき、患者さんにとって一日一日が重要なのと同様に、アムジェンにとっても一日一日が重要なのです。
COVID-19(新型コロナウイルス感染症)のワクチンは1年もかからずに提供可能になりました。では、なぜ他の種類の医薬品の開発には10年以上もかかるのでしょうか。この問いへの答えには、長いものと短いものがあります。
長い答えとしては、研究開発プロセスには無数のステップがあり、医薬品のベネフィットがリスクを上回ることを示すために長年の検討が必要、ということです。短く答えると、医薬品開発には非常に長く時間がかかるため、より早く、さらに早く進める必要があります。
世界的危機が科学を加速させることを示したパンデミック以前から、アムジェンの研究開発グループの戦略上、医薬品の開発スピードは最優先事項でした。研究開発担当のエグゼクティブ・ヴァイスプレジデントDavid Reeseは、「歴史的に見て、研究室でのアイデアに始まり、医薬品として承認され、患者さんに届くまでに平均12〜14年かかります」と述べます。「アムジェンは、医薬品開発のタイムラインをすでに約3年短縮してきました。しかし、まだ改善の余地はあります」
グローバル開発担当シニア・ヴァイスプレジデントのRob Lenzは、「私たちは、文字通り患者さんの命に関わる疾患にフォーカスしています」と話します。「がんや心疾患のような病気に、20年後の治療を求める人はいません。今すぐの治療を求めています」

こうした患者さんの切迫感は、医薬品開発チームと規制当局が協力し、画期的な治療法を一刻も早く確立することへの原動力となっています。最近承認されたアムジェンの肺がん治療薬は、臨床試験開始からわずか33ヶ月でFDAの承認を取得したことが、その一例です。このような例は、有望なプログラムを劇的に加速させる可能性を示しています。このスピードを例外とするのではなく、臨床パイプライン全体の標準とすることが、アムジェンのさらなる大きな目標です。
研究開発変革担当ヴァイスプレジデントのKimberly Clemensonは、「私たちは、デジタル技術や革新的な試験デザインから、規制当局とのパートナーシップに至るまで、複数の領域でスピード・レバー(加速器)を使っています」と述べます。「各医薬品開発チームにある多くのスピード・レバーをできるだけ統合して開発を加速させることが、私たちの目標です」
また、医薬品開発にかかるコストを管理し、成功率を上げる必要があり、これによりスピードはスロー・ダウンします。新薬の開発にかかるコストは、26億ドルを超えると推定されています。この金額には、臨床プログラムの約90%にあたる、承認に至らなかったプログラムへの費用も反映されています。
Lenzは、「開発の成功確率を上げるために、各ステージでより多くのデータを収集することはできます。しかし、それではプログラムの進行が遅くなってしまいます」と言います。「スピードを最適化しようとすると、コストが上がる傾向にあります。ただ、投資の振り分け方を最適化できれば、コストを下げられる可能性があります」
こうしたトレードオフを管理する方法の一つは、積極的に投資し、スピードを優先させることです。ある試験薬が臨床で成功し、良い治療法が他にほとんどない重症の患者さんを救う可能性が高いという強いエビデンスがあれば、積極的な投資は理にかなっています。
アムジェンでは、極めて有望なプログラムは「ファストレーン」の指定を受けることができます。研究担当エグゼクティブ・ディレクターのTara Arvedsonは、「ファストレーンアプローチでは、その医薬品研究に必要な理論上の最短時間を計算し、そのスピードを達成するために全力を尽くします」と述べます。
例えば、一般的な医薬品開発プログラムでは、臨床試験用の試験薬の大量生産などコストが大きくかかる活動は、その薬が実際に臨床で使えると確信できるまで遅らせます。ファストレーンに指定されたプログラムでは、成功に向けた計画を立て、多くの作業を順次ではなく並行して行います。より多くのスタッフが配属され、分子の安全性やその他の重要な特性を評価する科学者からのサポートを最初に受けることができます。臨床試験の準備も早期に行います。通常の開発では、ある段階から次の段階の間には、計画を立てるための「空白期間」がありますが、この空白期間をなくすということです。こうしたアプローチにより、成功する医薬品の開発期間を最大5年以上も短縮できます。
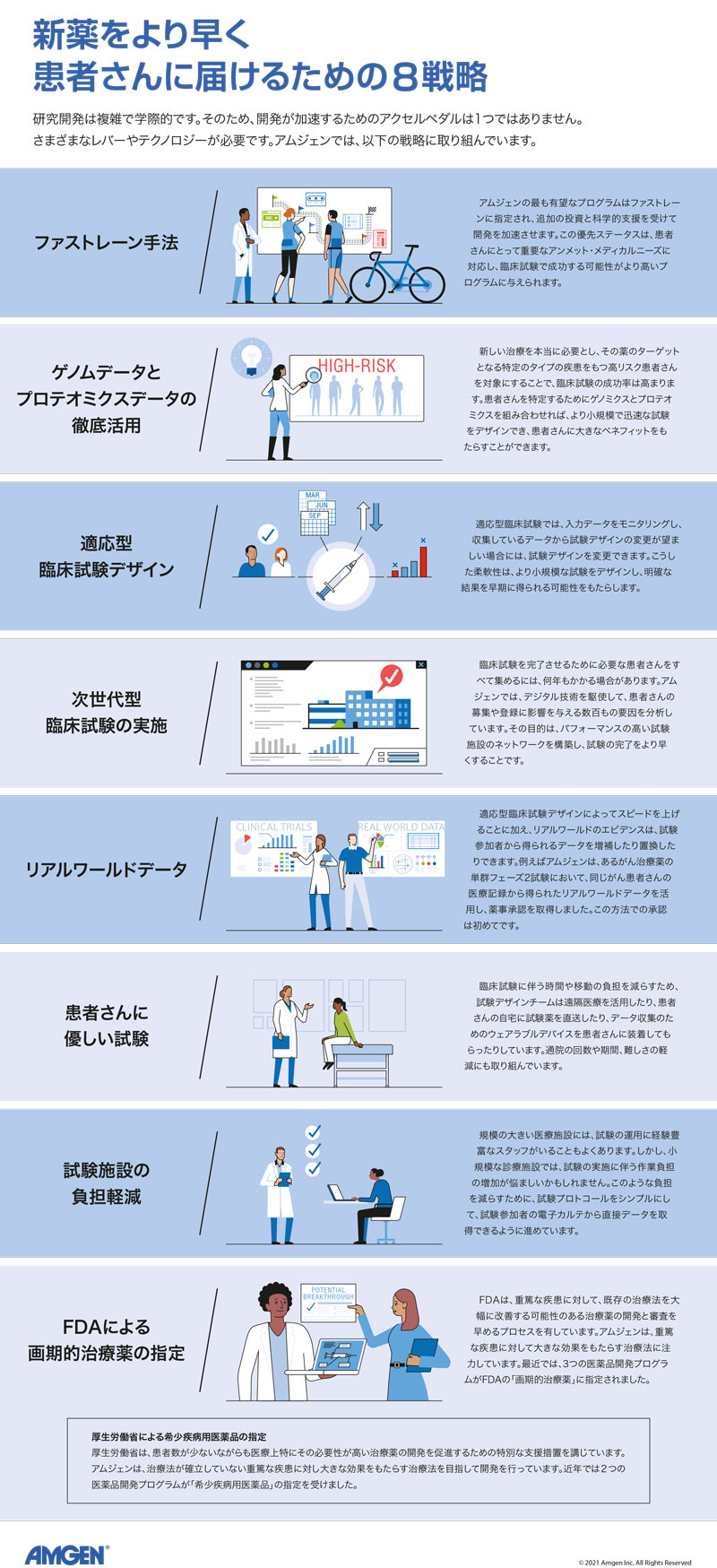
しかし、すべてのプログラムが最優先の扱いを受けられるわけではありません。Clemensonは、「ファストレーンアプローチは、私たちが最も確信を得ている、あるいは最も必要とされているプログラムのみ適用されます」と説明します。「そのため、製品ポートフォリオ全体にわたって幅広く適用できる、他のスピード・レバーの存在も探しています」
Lenzは、「適応型デザインでは、入力データをモニタリングし、試験が進む中で得られた知見に基づいてプロトコールを修正できます」と強調します。事前に設定された基準を満たせば、投与量の増減、試験規模や期間の拡大、薬が本当に役立つ患者さんのタイプを観察して多く登録するなど、さまざまな適応が可能です。
一般的には、このような柔軟性によって、より短期間で明確な結果が得られる小規模試験をデザインできるようになります。Lenzは、「ある薬やその投与量が有効かどうかの確信を早く得ることができれば、その薬を先に進めるか、患者さんにおける評価を止めるか、その判断がより早くできます」と話します。
ゲノムデータとプロテオミクスデータは、多くの試験で、規模と期間を膨らませている問題の解決に役立ちます。アスピリンが頭痛のない人の頭痛を和らげることができないように、試験薬は病態の安定した人の悪化を防ぐことができません。最近まで、疾患の進行リスクの高い人を特定することは困難でした。この不確実性に対して、これまでの通常の方法では、より多くの患者さんをより長期間試験に組み込み、薬が効いた場合に、薬の真のベネフィットを示すのに十分な数の患者さんを確保してきました。
こうした不確実性を低減するために役立つのが、ポリジェニック・リスクスコアです。ポリジェニックとは、多遺伝子という意味です。ポリジェニックスコアでは、ときには数百万にも上るDNA中の共通の遺伝子変異の集合効果に基づいてリスクを算出します。この手法により、標準的な診断テストではリスクが低いまたは中程度と思われる人でも、実際には疾患の進行に深刻なリスクを抱えている可能性を明らかにできます。
Lenzは、「予後が不良なリスクの高い患者さんほど、治療薬の効果はより早く、より明確に現れると考えられます」と言います。「アムジェンでは、ヒトゲノミクスとその関連データを用いて、試験の規模や期間を縮小し、成功率と治療効果の大きさを高め、医薬品として承認されて必要とする患者さんの手元により早く届けることを目指しています」

プロセス改善担当エグゼクティブ・ディレクターのTaras Carpiacは、「試験のスピードは、患者さんをできるだけ早く登録することに大きく依存しています。同様に、パフォーマンスの高い試験施設のネットワークを構築することにもかかっています」と話します。「試験施設を選定する従来の方法は、治験責任医師の候補者にアンケートを送り、『これが私たちの試験の大まかなデザインです。参加してみませんか。どれくらいの患者さんを登録できそうですか』と尋ねます。この方法では、依頼するときの判断材料は、その医師が過去の試験で何人患者さんを登録したかなど、わずかな要素しかありません」
一握りの要素に基づく予測はあまり正確ではないと、グローバル臨床プログラムマネジメント担当ディレクターのJulie Argentoは述べています。「業界全体では、試験に参加表明した施設の約15%が、1人も患者さんを登録していません。疾患によっては、その割合がさらに上がります」。この組み入れの誤差は、試験全体を遅らせることになります。
より良い予測を得るために、アムジェンはデジタルイノベーションと人工知能に注目しています。Argentoは、「機械学習のアプローチを導入することで、試験施設を選定する際に何百もの特性を考慮できるようになっています」と言います。「異なる地域における特定の患者集団、施設の研究能力やインフラ、スタッフの人数、ゲノムスクリーニングの経験など、登録における主要な要因を特定できるのです。これにより、心強い登録施設となる可能性のあるところと、登録者が出ないと予測される施設を区別できます」
「患者さんにとって良いニュースとは、私たちがバイオテクノロジーへの投資を今まで以上に増やしていることを示し、より多くの新薬の可能性の発見につなげているということです。しかし、これは、業界内での競争がかつてないほど激しくなっていることの表れでもあります。複数の企業が、有望と見られるほぼすべての創薬ターゲットを追い求めているのです。科学イノベーションは依然として不可欠ですが、新薬の成功のために、さらに重要になっているのがスピードです」
Rob Lenz
追加業務、例えば患者さんの募集や評価、詳細な診断検査、データの収集や入力と整理などは、ただでさえ多忙な医療現場を圧迫しかねません。こうした負担を軽減するためには、必要なデータを作成するためにプロトコールをできるだけ簡略化したり、試験参加者の電子カルテから多くのデータを直接集めたりすることが挙げられます。Carpiacは、「標準的な医療業務の中に、試験業務がシームレスに組み込まれるような試験をデザインするという発想です」と言います。
また、患者さん中心の試験デザインは、参加しやすくなることで募集もスピードアップできます。業界の基準によると、試験に登録された患者さんは、通院するたびに平均で往復50マイル(約80キロメートル)以上移動します。「このような患者さんは、疾患によってすでにライフスタイルが大きく損なわれている場合が多いのです」と、Carpiacは指摘します。通院回数や期間、難易度を減らすことで、患者さんが試験への登録を断念したり、試験開始後に脱落する原因となる障壁を下げることができます。
この目的のために、アムジェンは可能な限り分散型アプローチの採用を進めています。「分散化とは、在宅医療訪問や遠隔医療、ウェアラブルデバイスによるデータ収集、患者さんの自宅へ試験薬を直送するなど、あらゆることを意味します」と、Carpiacは言います。このソリューションは、COVID-19パンデミックによって必要とされたために始まったものです。しかし、今では患者さんにとってより優しい試験となり、登録がスピードアップする方法として受け入れられていると、Carpiacは述べます。
患者さんの参加負担だけでなく、施設の参加負担を減らすことで、臨床試験の多様性を向上させるという目標も達成できます。負担を減らした試験は、大規模な大学病院だけでなく、より地域に根ざした診療所にまで臨床研究の場を広げることができ、試験参加者がより幅広い患者集団の特徴をもつようにできます。
アムジェンは、歴史的にファースト・イン・クラスの医薬品を提供することに長けています。アムジェンの製品ポートフォリオにある20の革新的医薬品のうち、13がファースト・イン・クラスの指定を受け、さらに3つはアムジェンが開発した初期のファースト・イン・クラスのメカニズムがベースになっています。ただ、この実績を維持することは、今後難しくなるでしょう。
「患者さんにとって良いニュースとは、私たちがバイオテクノロジーへの投資を今まで以上に増やしていることを示し、より多くの新薬の可能性の発見につなげているということです。しかし、これは、業界内での競争がかつてないほど激しくなっていることの表れでもあります。複数の企業が、有望と見られるほぼすべての創薬ターゲットを追い求めているのです。科学イノベーションは依然として不可欠ですが、新薬の成功のために、さらに重要になっているのがスピードです」
Reeseは、「パンデミックに対応するために開発されたmRNAワクチンは、私たちにできること、達成可能なラインを示しました」と述べます。「それこそが、私たちが日々努力して目指すべきところなのです」
英文オリジナル記事はこちら